Tip 1: Jaká je chemická struktura
Tip 1: Jaká je chemická struktura
Teorie chemické struktury je teorie, kterápopisuje pořadí, v němž jsou atomy uspořádány v molekulách organických látek, jaký vzájemný vliv atomy působí na sebe a také, jaké chemické a fyzikální vlastnosti látky vystupují z tohoto řádu a vzájemného vlivu.

Tip č. 2: Jaká jsou poměrně nová čísla?
Vzájemně primární čísla jsou matematické pojmy, které by neměly být zaměňovány s čísly jednoduchými. Společné mezi oběma pojmy je pouze to, že oba mají přímý vztah k rozdělení.

Jednoduchý v matematice se nazývá číslo,které lze rozdělit pouze na jednu a na sebe. 3, 7, 11, 143 a dokonce i 111 111 111 jsou všechna přední čísla, z nichž každá má tuto vlastnost samostatně. Abychom mohli mluvit o vzájemně prvočíselných číslech, musí existovat alespoň dva z nich. Tento koncept charakterizuje společný rys několika čísel.
Definice relativně prvočíselných čísel
Vzájemně jednoduché jsou ty číslicenemají žádný společný dělitel, a to včetně prvků - například, 3 a 5. V tomto případě je každé číslo zvlášť nemůže být jednoduchý v sobě sebe.Naprimer číslo 8 se týká těch, které nejsou, protože mohou být rozděleny o 2 a 4, ale 8 a 11 jsou poměrně počáteční čísla. Definování charakteristiky zde je absence společný faktor, spíše než charakteristiky jednotlivých chisel.Vprochem, dva nebo více prvočísla jsou vždy coprime. Jestliže každý z nich je dělitelná pouze jeden a sám o sobě, společným faktorem oni nemají mozhet.Dlya relativně prvočísla je speciální označení ve formě horizontální linii a hodil ji kolmo. To je v souladu s vlastností kolmých linií, které nemají žádný společný směr, neboť neobsahují žádné společného dělitele.Pairwise vzájemně předčí čísla
Snad kombinaci relativně prvních čísel,ze kterých si můžete vzít jakékoliv dvě čísla náhodně, a to se ukázalo jako relativně připravit. Například, 2, 3 a 5: žádný společný dělitel jsou 2 a 3 audio, audio 2 a 5 nebo 5 a 3. Tato čísla se vztahují prostye.Ne vždy dvojicích relativně prvočísla jsou dvojicích relativně připravit. Například čísla 15, 20 a 21 - je relativně prvočíslo, ale jsou relativně prvočíslo nemůže vyjmenovat, protože 15 a 20 jsou rozděleny do 5 a 15, a 21 - 3.Použití vzájemně prvočíselných čísel
V řetězovém přenosu se zpravidla jedná o množstvířetězové články a zuby řetězových řetězců jsou vyjádřeny vzájemně primárními čísly. Kvůli tomu se každý ze zubů dotýká každého článku řetězce, mechanizmus se opotřebovává méně. Existuje ještě zajímavější vlastnost vzájemně předurčených čísel. Je třeba nakreslit obdélník, jehož délka a šířka jsou vyjádřeny vzájemně prvočíslami a nakreslíme paprsek z úhlu uvnitř obdélníku pod úhlem 45 stupňů. V místě styku paprsku se stranou obdélníku je třeba kreslit jiný paprsek, umístěný pod úhlem 90 stupňů od prvního, odraz. Takovéto paprsky reflexe se časem mohou dostat geometrickým vzorem, ve kterém je jakákoliv část struktury podobná celku. Z hlediska matematiky je tento vzor fraktální.Tip č. 3: Co je lidský zažívací systém
Osoba potřebuje žítživiny: proteiny, aminokyseliny, monosacharidy a podobně. To vše je v jídle, ale v složité, málo stravitelné formě. Aby buňky dostaly látky, které potřebují, musí být potraviny rozděleny. Tento úkol provádí trávicí systém systému.
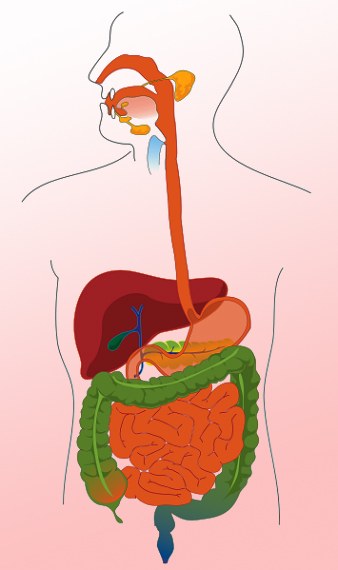
Tip č. 4: Co je to inertní plyn
Inertní plyny v periodické tabulce jsou prvkyhlavní podskupina skupiny VIII: hélium, neon, argon, krypton, xenon a radon, které jsou radioaktivními prvky. Jsou také nazývány vzácnými plyny.

Elektronická struktura inertních plynů
Všechny inertní plyny mají kompletní, stabilníkonfigurace externí elektronické úrovně: hélium je dublet, zbývající plyny mají oktet. Každá z nich dokončí odpovídající periodu v periodické tabulce.Inertní plyny v přírodě
Všechny inertní plyny, kromě radioaktivního radonu,lze nalézt v atmosférickém vzduchu. Hélium je nejběžnějším prvkem ve vesmíru po vodíku. Slunce je 10% složené z tohoto vzácného plynu, tvořeného z vodíku reakcí jaderné fúze s uvolňováním pozitronů a antineutrinos.Fyzikální vlastnosti vzácných plynů
Inertní plyny jsou reprezentovány monatomickýmimolekul. Za normálních podmínek, hélium, neon, argon, krypton a xenon - plyny bez barvy a zápachu, špatně rozpustné ve vodě. Čím větší je jejich atomové číslo, tím vyšší je teplota varu a teplota tání. Hélium má jedinečné vlastnosti: zůstává tekuté i při nejnižších teplotách až na absolutní nulu, aniž by prošla krystalizací. Krystalizace hélia je možná pouze při tlaku 25 atmosfér. Kromě toho má tento plyn nejnižší bod varu všech látek.Chemické vlastnosti vzácných plynů
Po dlouhou dobu se věřilo obecně inertním plynůmnetvoří spojení. Nicméně experimentálně za zvláštních podmínek byly získány fluoridy a oxidy xenonů, jejichž existence předpovídal teoretik Linus Pauling.Jak používat inertní plyny
Díky své vynikající fyzikálně-chemické vlastnostivlastnosti inertních plynů jsou široce používány ve vědě a technologii. Tak, s kapalným heliem vyrobeného velmi nízké teploty, a směs helia a kyslíku v poměru 4: 1 se používá jako umělé dýchání atmosféry vodolazov.Poskolku helium - nejjednodušším plynu po vodík, jsou často vyplněny vzducholodě, balóny a sond. Jeho zvedací síla rovná 93% zdvihového vodoroda.Neon, argon, krypton a xenon se používají v osvětlovací techniky - výrobu výbojek plněných plynem. Je-li elektrický proud prochází trubicí naplněnou neon nebo argonem začne svítit, a barva tohoto světla závisí na gaza.Argon tlaku jako nejdražší vzácných plynů se používá k vytvoření inertní atmosféry v průběhu chemických reakcí, jejichž produkty interakci s kyslíkem.Tip 5: Co je atomová orbita
Každá látka v přírodě se skládá z nejmenšíchčástice nazývané atomy. Jejich rozměry jsou tak malé, že v podstatě tyto částice nebyly nikdy viděny a údaje o jejich struktuře a vlastnostech jsou založeny na četných experimentech používajících různé složité nástroje.

Struktura atomu
Atom se skládá ze dvou hlavních částí: jádro a elektronová skořepina. Jádrem je jádro kombinace protonů a neutronů, které se společně nazývají nukleony; Elektronický obal jádra se skládá pouze z elektronů. Jádro má kladný náboj, obálka je záporná a spolu tvoří elektricky neutrální atom.Historie
Jak již bylo řečeno, atom se skládá z jádra aelektrony se pohybují kolem něj. Často, abychom zjednodušili schematické kresby atomů, věřte, že se elektrony otáčejí v kruhových oběžných drahách, jako jsou planety sluneční soustavy kolem slunce. Tento živý model byl navržen v roce 1911 vynikajícím anglickým fyzikem Ernestem Rutherfordem. Nicméně to nebylo možné dokázat experimentálně a termín "orbita" byl postupně opuštěn. Již na počátku 30. let dvacátého století bylo konečně prokázáno, že elektron v atomu nemá určitou trajektorii pohybu. Tehdy se v pracích amerického fyziků Roberta Mullikena a německého fyziků Maxa Borna začal objevovat nový termín - orbitální - souhláská a uzavřená ve smyslové oběžné dráze.Elektronický mrak
Elektronický mrak je celá sada bodů,v níž elektron prochází po určité časové období. Tato oblast elektronového mraku, ve kterém se elektron objevuje častěji, je orbitální. Nejčastěji s definicí tohoto pojmu říkají, že toto je místo atomu, kde je umístění elektronu s největší pravděpodobností. Slovo "pravděpodobně" hraje klíčovou roli zde. V podstatě může být elektron v libovolné části atomu, ale pravděpodobnost, že ji najde někde mimo orbitaly, je extrémně malá, takže se běžně předpokládá, že orbitální je asi 90% elektronového mraku. Graficky je orbital zobrazen ve formě povrchu, který vymezuje oblast, kde je nejpravděpodobnější vzhled elektronu. Například u atomu vodíku má orbitál sférický tvar.Typy orbitálů
V současné době vědci definují pět typůorbitály: s, p, d, f a g. Jejich tvary byly vypočteny pomocí metod kvantové chemie. Orbitaly existovat bez ohledu na to, zda je elektron k nim, nebo ne, a atomy každého prvku, nyní známý, má plnou sadu moderní chemie orbitaley.V Orbital je jedním z klíčových pojmů, které umožňuje zkoumat procesy tvorby chemických vazeb.Rada 6: Jaká je valence
Valence - jeden z hlavních termínů používaných vteorie chemické struktury. Tento koncept určuje schopnost atomu vytvářet chemické vazby a kvantitativně vyjadřuje počet spojení, ve kterých se účastní.
Pokyny
1
Valence (z latiny. Valentia - «síla») - indikátor schopnosti atomu převzít jiné atomy, které tvoří chemické vazby v molekule s nimi. Celkový počet vazeb, které se mohou podílet atom, se rovná počtu nepárových elektronů. Takové vazby se nazývají kovalentní vazby.
2
Nepálenými elektrony jsou volné elektronyvnější skořápku atomu, které jsou spojeny s vnějšími elektrony jiného atomu. Každý takový pár se nazývá elektron, a takové elektrony jsou valence. Vycházíme z toho, že definice valence může znít takto: to je počet elektronových párů, na kterých je daný atom vázán na jiné atomy.
3
Valence atom je schematicky znázorněn v strukturních chemických vzorcích. Pokud taková informace není nutná, použijí se nejjednodušší vzorce, v nichž není mínění uvedeno.
4
Maximální valence chemických látekprvky jedné skupiny periodického systému se zpravidla rovnají pořadovému číslu skupiny. V různých chemických sloučeninách mohou mít atomy jednoho prvku různé valence. Polarita výsledných kovalentních vazeb není brána v úvahu, takže valence nemá žádné znamení. Nemůže to být ani nula ani negativní.
5
Kvantitativní míra jakéhokoli chemického prvkuje obvyklé zvážit počet monovalentních atomů vodíku nebo dvojmocných atomů kyslíku. Avšak při stanovení valence mohou být použity i další prvky, jejichž valenci je dobře známa.
6
Někdy je pojmenován koncept valencetermín "stupeň oxidace", ale to není pravda, i když v některých případech jsou tyto ukazatele stejné. Stupeň oxidace je formální termín, což znamená možný náboj, který by atom dostal, kdyby se jeho elektrony v elektronových párech přenesly na více elektonergativní atomy. V tomto případě je stupeň oxidace vyjádřen v jednotkách náboje a může mít znaménko, na rozdíl od válence. Tento termín se rozšířil v anorganické chemii, protože je těžké posoudit valenci v anorganických sloučeninách. Valence Používá se také v organické chemii, protože většina organických sloučenin má molekulární strukturu.
Tip 7: Co je iontová vazba?
Iontová vazba je jednou z odrůdchemická vazba, která vzniká mezi proti sobě nabitými ionty elektropozitivních a elektro-negativních prvků. Jak je dobře známo, ionty jsou částice nesoucí pozitivní nebo záporný náboj, které jsou tvořeny atomy při zpětném rázu nebo připojení elektronů.

Tip 8: Co je cytoplazma
Cytoplasma je velmi důležitá buněčná složka. V polotuhém vnitřním prostředí jsou organely odpovědné za životně důležité funkce buňky. Mobilita cytoplazmy podporuje interakci organel mezi sebou. To umožňuje vznik procesů intracelulárního metabolismu.






